(BFM Bourse) - Le groupe a reçu un avis d’insuffisance de la part de Health Canada, l’agence de la santé canadienne, dans le cadre de la demande de mise sur le marché du mastinib dans le traitement de la sclérose latérale amyotrophique, également appelée maladie de Charcot.
AB Science pouvait espérer obtenir un important feu vert réglementaire pour sa molécule phare, mastinib, à la fin de cette année. Ce ne sera pas le cas.
La société de biotechnologies fondée en 2001 et introduite en Bourse en 2010, attendait une potentielle autorisation avant la fin de l’année de la part de Health Canada, l’agence de la santé canadienne. Cette autorité examine depuis mai dernier le mastinib dans le traitement la sclérose latérale amyotrophique (SLA, également appelée maladie de Charcot) dans le cadre d’une procédure accélérée dite "NO/c".
La SLA se caractérise par une dégénérescence et la mort de certains motoneurones qui cessent d’envoyer des messages aux muscles, causant ainsi une paralysie progressive. Elle cause le décès du patient à l’issue d’une période allant de 3 à 5 ans. Sa prévalence dans les pays occidentaux est d'environ 6 pour 100.000 personnes, ce qui correspond à environ 30.000 cas en Europe et 20.000 aux États-Unis.
90 jours pour répondre
AB Science a annoncé mardi soir qu’Health Canada lui avait envoyé un avis d’insuffisance ("Notice of deficiency" ou "NOD") sur cette demande de mise sur le marché pour le traitement de la SLA .
Cet avis d’insuffisance signifie que l’agence sanitaire canadienne a demandé à AB Science la communication d’informations supplémentaires dans le cadre de cette demande. Health Canada a logiquement interrompu l’examen de mastinib.
L'entreprise dispose désormais d’un délai de 90 jours pour répondre à l’avis d’insuffisance émis par Health Canada. "AB Science va se rapprocher de Health Canada afin de répondre aux objections de l’agence, avec l'intention de reprendre le processus d’examen du dossier dans les délais impartis", a assuré la société dans un communiqué.
"Notons qu’il ne s’agit pas ici d’un refus qui prendrait la forme d’un avis de non-conformité (Notice of Non-compliance - NON) en cas de dossier jugé incomplet ou non conforme. A ce stade, l’examen du dossier d’AB Science n’est donc pas terminé", remarque Invest Securities.
Une demande en Europe
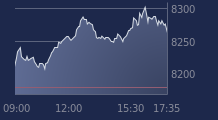
A la Bourse de Paris, cet impair grippe les investisseurs. Le titre AB Science plonge de 32% vers 10h20, accusant la plus forte baisse de tout le compartiment B de la Bourse de Paris. Ce qui creuse les pertes de la valeur sur l’ensemble de 2022 à près de 50%, pour une capitalisation de 284 millions d’euros.
Outre l’examen prioritaire au Canada, AB Science a déposé fin août une demande d’autorisation pour mastinib dans le traitement de la SLA auprès de l’Agence européenne du médicament (EMA). La demande a été validée et l’examen du dossier par comité des médicaments à usage humain de l’EMA doit rendre son avis dans un délai de 210 jours, soit vers fin mars a priori.
La biotech a aussi reçu l’aval de plusieurs agences de santé pour initier une étude de phase III (dernière étape des essais cliniques avant une éventuelle commercialisation) visant à évaluer mastinib pour le traitement de la maladie d’Alzheimer. Le mastinib d’AB Science a par ailleurs déjà été enregistré en Europe et aux Etats-Unis en médecine vétérinaire.
Recevez toutes les infos sur AB SCIENCE en temps réel :
Par « push » sur votre mobile grâce à l’application BFM Bourse
Par email