(BFM Bourse) - Le spécialiste des vaccins contre les maladies infectieuses a annoncé que l'autorité sanitaire américaine avait suspendu son vaccin Ixchiq en raison de quatre cas d'effets indésirables graves, ce qui interrompt les ventes dans le pays.
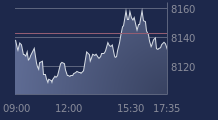
Valneva plonge à la Bourse de Paris. Le spécialiste des vaccins contre les maladies infectieuses chute de 23% vers 11h55, accusant de loin la plus forte baisse du SBF 120.
Le groupe nantais a annoncé ce lundi 25 août que la Food and Drug Administration (FDA), l'autorité sanitaire américaine, avait suspendu la licence accordée à Ixchiq, son vaccin contre le chikungunya.
Cette suspension a déjà pris effet et interrompt de facto les expéditions et les ventes du vaccin aux États-Unis.
La FDA a cité quatre nouveaux cas d'effets indésirables graves pour justifier cette suspension de licence. Sur ces quatre cas rapportés, trois sont survenus chez des personnes âgées de 70 à 82 ans, avec l’hospitalisation de cette dernière qui a pu sortir après deux jours. Le cas restant est survenu chez une personne de 55 ans, a indiqué Valneva.
Ces cas ont été recensés dans les données du système de surveillance américain "VAERS" pour "Vaccine Adverse Event Reporting System".
>> Accédez à nos analyses graphiques exclusives, et entrez dans la confidence du Portefeuille Trading
Vers de potentiels recours
En creux, l'entreprise française fait comprendre qu'elle n'estime pas justifiée la décision de l'autorités américaine.
"Valneva estime que ces cas présentent des symptômes comparables à ceux rapportés précédemment, lors des essais cliniques et après la mise sur le marché du vaccin, en particulier chez les personnes âgées pour lesquelles l’indication du vaccin comprend des mises en garde et des mesures de précautions", a déclaré la société dans un communiqué.
Le groupe continue "d‘analyser ces cas en détail et, effectuera, si nécessaire, d’éventuelles démarches relatives à la décision de la FDA, conformément aux procédures juridiques applicables", ajoute-t-il.
Valneva indique étudier actuellement l'impact que pourrait avoir un retrait définitif de la licence de son vaccin aux États-Unis.
Ce vaccin avait généré un total de 7,5 millions d'euros de ventes au premier semestre 2025, représentant ainsi moins de 10% du total des revenus de Valneva (91 millions d'euros).
"À moyen terme (4-5 ans), et selon nos estimations, Ixchiq pourrait générer un pic de ventes annuelles autour de 200 millions d'euros", estimait en avril Mohamed Kaabouni, analyste chez Portzamparc.
Essais cliniques attendus en fin d'année
Le vaccin avait déjà connu des remous ces derniers mois. L'Union européenne et les États-Unis avaient restreint son utilisation au printemps, excluant alors les personnes âgées, avant de lever ces restrictions durant l'été.
Les deux autorités avaient limité de manière temporaire l'utilisation du vaccin, le temps de mener une revue après que des effets indésirables graves soient survenus sur l'île de la Réunion. Le département français a connu une épidémie importante au printemps dernier, ce qui avait conduit les autorités à faire appel au vaccin de Valneva avec la livraison de 40.000 doses.
Le vaccin Ixchiq de Valneva est actuellement commercialisé dans l'Union européenne, au Canada, au Royaume-Uni ainsi qu'aux États-Unis. En avril dernier, le Brésil a à son tour approuvé Ixchiq, ce qui constituait alors la première approbation mondiale d'un pays où la maladie est endémique, c'est-à-dire qu'elle est constamment présente sur le territoire.
Valneva a par ailleurs obtenu l'extension de l'utilisation d'Ixchiq chez les adolescents âgés de 12 à 17 ans en avril dernier dans l'Union européenne et la semaine dernière au Canada.
Le groupe a également soumis une demande d'approbation de cette extension aux États-Unis.
Au-delà de l'actualité liée à Ixchiq, la publication des résultats de l'essai clinique de phase III (dernière étape avant une potentielle commercialisation) évaluant le vaccin VLA15 de Valneva contre la maladie de Lyme constituera le grand rendez-vous des marchés. La société a indiqué mi-août que ces résultats étaient attendus après fin octobre.
Ce vaccin est codéveloppé avec l'américain Pfizer et Valneva prévoit de demander une autorisation de mise sur le marché aux autorités sanitaires américaines et européennes en 2026.
"Si le vaccin est approuvé et commercialisé, Valneva pourrait recevoir de Pfizer jusqu’à 143 millions de dollars de paiements liés aux premières étapes de commercialisation du produit, des redevances sur les ventes allant de 14% à 22% ainsi que des paiements d’étape basés sur les ventes cumulées pouvant atteindre 100 millions de dollars", avait alors rappelé l'entreprise.
Recevez toutes les infos sur VALNEVA en temps réel :
Par « push » sur votre mobile grâce à l’application BFM Bourse
Par email