(BFM Bourse) - Le spécialiste des vaccins contre les maladies infectieuses a dévoilé des résultats cliniques intermédiaires prometteurs pour son candidat vaccin VLA15 contre la maladie de Lyme.
Valneva a connu une fin de mois d'août mouvementée à la Bourse de Paris. L'action du spécialiste des vaccins pour les maladies infectieuses s'était effondrée de 22,18% le 25 août dernier, plombée par la suspension des ventes de son vaccin contre le chikungunya aux États-Unis, après quatre cas d'effets indésirables graves.
Cette fois-ci, Valneva annonce une bonne nouvelle concernant l'un de ses vaccins en cours de développement. Le groupe spécialisé dans les vaccins contre les maladies infectieuses a publié mercredi 3 septembre de nouvelles données encourageantes pour VLA-15, son candidat vaccin contre la maladie de Lyme, développé en collaboration avec Pfizer.
Causée par des piqures de tiques, cette maladie peut engendrer des complications articulaires, nerveuses ou cutanées si elle n'est pas traitée au stade primaire. Il n'existe pour l'heure aucun vaccin humain contre cette maladie.
Une forte réponse immunitaire
Les données publiées par Valneva, issues de la phase II, soit à un stade intermédiaire qui vise à démontrer l'efficacité d'un traitement, ont ainsi montré une forte réponse anamnestique (mémoire immunitaire), un mois après l'administration d'une troisième dose de rappel de VLA15 au 42eme mois chez les enfants âgés de 5 à 11 ans), les adolescents (âgés de 12 à 17 ans) ainsi que chez les adultes (âgés de 18 à 65 ans).
"La forte réponse immunitaire et le profil d'innocuité favorable observé après avoir reçu cette troisième dose de rappel étaient similaires à ceux rapportés après avoir reçu les précédentes doses de rappel démontrant ainsi le bénéfice potentiel que pourrait avoir une vaccination de rappel avant chaque saison de maladie de Lyme", explique Valneva.
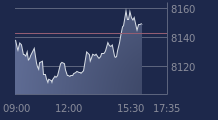
A la Bourse de Paris, l'action Valneva progresse après l'annonce de ses résultats, gagnant 8,5% peu avant 15h.
Des résultats de phase III en fin d'année
La publication des résultats de l'essai clinique de phase III (dernière étape avant une potentielle commercialisation) évaluant le vaccin VLA15 de Valneva contre la maladie de Lyme est attendue après la fin du mois d'octobre. L'objectif étant que le géant américain soumette une demande d’autorisation de mise sur le marché (BLA) à l’agence de santé américaine FDA et une demande d'autorisation de mise sur le marché (AMM) à l'Agence Européenne des Médicaments en 2026, sous réserve que les données obtenues soient positives.
"Si le vaccin est approuvé et commercialisé, Valneva pourrait recevoir de Pfizer jusqu’à 143 millions de dollars de paiements liés aux premières étapes de commercialisation du produit, des redevances sur les ventes allant de 14% à 22% ainsi que des paiements d’étape basés sur les ventes cumulées pouvant atteindre 100 millions de dollars", avait alors rappelé l'entreprise dans une précédente communication.
Le groupe a également confirmé mi-août que les résultats de phase I, phase qui évalue la sécurité d'emploi d'un traitement, de son candidat-vaccin contre le virus Zika étaient attendus cette année. Le groupe a par ailleurs deux essais de phase II (étape qui évalue l'efficacité et la tolérance d'un traitement) qui évaluent actuellement un candidat-vaccin contre la shigellose, une diarrhée infectieuse aigüe.
Recevez toutes les infos sur VALNEVA en temps réel :
Par « push » sur votre mobile grâce à l’application BFM Bourse
Par email