(BFM Bourse) - L'action de la biotech tricolore chute vendredi alors que l'Agence américaine du médicament a ordonné la suspension des essais menés avec son partenaire américain, Allogene Therapeutics, d'un nouveau type de traitement du cancer.
Nouveau coup dur pour Cellectis, une biotech française figurant parmi les pionniers mondiaux d'un nouveau type de traitement des cancers fondé sur l'utilisation de globules blancs issus de donneurs (dit allogénique). Son principal partenaire, l'américain Allogene Therapeutics, a fait part au marché jeudi soir d'une mauvaise nouvelle: la suspension des essais menés aux Etats-Unis à la suite de la survenue d'une anomalie chromosomique chez un patient, parmi la centaine déjà traitée.
Allogene est la nouvelle société créée par les fondateurs et dirigeants de Kite Pharma, à la suite du rachat en 2017 de cette dernière entreprise par Gilead pour 11,9 milliards de dollars. Une opération couronnant la réussite d'un nouveau traitement contre le cancer appelé Yescarta, à base de cellules CAR-T (Chimeric Antigen Receptor-T cells): des lymphocytes prélevés sur le patient, modifiés pour exprimer ce récepteur antigénique chimérique permettant de mieux cibler les cellules cancéreuses, et réinjectés au patients. Les thérapies CAR-T (outre Yescarta les seules commercialisées à ce jour étant Kymriah de Novartis et Abecma de BMS) aboutissent à des résultats spectaculaires, avec des taux de rémission allant jusqu'à 90% parmi des patients en phase terminale, mais peinent à trouver leur modèle économique en raison du coût lié au procédé de fabrication complexe, répété de A à Z pour chaque patient.
Plusieurs biotechs, dont le français Cellectis, s'efforcent de développer une technologie permettant d'utiliser des CAR T allogéniques (plutôt que l'approche autologue initiale), autrement dit une thérapie fabriquée à partir des cellules de donneurs sains, modifiées pour s'adapter ensuite à tous les patients, afin de permettre une production à grande échelle et donc de réduire les coûts.
Anomalie chromosomique chez un patient
Initialement, Cellectis avait conclu des accords de licence avec Pfizer et Servier. Les anciens dirigeants de Kite Arie Belldegrun et David Chang ont ensuite porté Allogene sur les fonds baptismaux en rachetant les droits concédés à Pfizer sur le portefeuille de médicaments CAR-T allogéniques (et signant un accord de partenariat avec Servier pour les programmes menés avec ce dernier). Allogene est donc devenu de facto le principal partenaire de Cellectis.
Jeudi soir, la biotech californienne a annoncé avoir rapporté à l'Agence américaine du médicament, la FDA, la découverte d'une anomalie chromosomique chez un patient participant à l'étude "ALPHA 2", atteint d'un lymphome non hodgkinien à un stade très avancé en rechute après des traitements standards. Un prélèvement de ses propres lymphocytes n'avait pas permis d'obtenir suffisamment de cellules pour produire une thérapie CAR-T autologue, il lui a été proposé de prendre part à l'essai avec un traitement allogénique.
Après celui-ci l'organisme du patient a connu un début de réponse clinique, suffisant pour tenter par la suite une greffe de moelle osseuse (traitement standard des lymphomes agressifs). Parallèlement, le patient a développé une pancytopénie (une baisse simultanée des trois lignées sanguines globules rouges, globules blancs et plaquettes) progressive qui a amené les médecins à réaliser une biopsie de la moelle osseuse pour essayer d'en déterminer les causes. La biopsie a confirmé une anémie aplasique et la présence de cellules CAR T modifiées ALLO-501A porteuses d'une anomalie chromosomique. Les chercheurs étudient actuellement cette anomalie, pour évaluer son impact clinique et vérifier si l'anomalie se multiplie et si la modification génétique liée au produit peut en être responsable.
Une investigation qui prendra du temps
Tout en plaçant la sécurité des patients en tête de ses priorités, Allogene estime que les données générées jusqu'ici dans les différents essais ALPHA (plus de 100 patients au total) témoignent d'un profil clinique qui reste favorable. "En tant que principal acteur des thérapies cellulaires allogéniques, nous reconnaissons une responsabilité supplémentaire à évaluer pleinement tous les aspects de nos thérapies pour faire progresser ce domaine", indique la firme, qui continue à travaille en étroite collaboration avec la FDA.
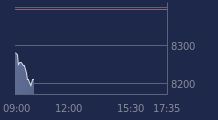
En attendant le verdict de l'agence (sachant que l’investigation pourrait durer plusieurs semaines, selon Oddo BHF), le cours de Bourse de Cellectis ne s'en trouve pas moins sous pression, perdant 16,8% à 8,73 euros vers 10h45.
Recevez toutes les infos sur CELLECTIS en temps réel :
Par « push » sur votre mobile grâce à l’application BFM Bourse
Par email