(BFM Bourse) - Le spécialiste des vaccins contre les maladies infectieuses a dévoilé des résultats cliniques intermédiaires positifs pour son candidat vaccin VLA15 contre la maladie de Lyme.
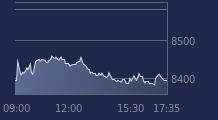
Valneva progresse en Bourse, ce mercredi 26 novembre. L'action du spécialiste des vaccins reprend 6,4% en fin de matinée, portant sa hausse sur l'ensemble de 2025 à 85%.
La progression du titre Valneva est à mettre en perspective avec des données cliniques positives pour l’un de ses vaccins en cours de développement.
Le groupe spécialisé dans les vaccins contre les maladies infectieuses a publié de nouvelles données encourageantes pour VLA-15, son candidat vaccin, développé en collaboration avec Pfizer, ciblant la Borrelia, la bactérie à l’origine de la maladie de Lyme.
Causée par des piqures de tiques, cette maladie peut engendrer des complications articulaires, nerveuses ou cutanées si elle n'est pas traitée au stade primaire. Il n'existe pour l'heure aucun vaccin humain contre cette maladie.
Des résultats intermédiaires positifs
Les données publiées par Valneva, issues de la phase II, soit à un stade intermédiaire qui vise à démontrer l'efficacité d'un traitement, ont ainsi montré une forte réponse anamnestique (mémoire immunitaire), et un profil de sécurité favorable six mois après une troisième dose de rappel dans toutes les tranches d’âge.
Valneva fait donc valoir que ces données confirment le bénéfice anticipé d’une vaccination annuelle avant chaque saison de Lyme. La saison d’activité des tiques en France s’étend de mars au mois de novembre, rappelle Santé Publique France.
Le spécialiste des vaccins contre les maladies infectieuses a précisé que les taux d’anticorps restaient nettement supérieurs à leur niveau initial, surtout dans un schéma vaccinal à trois doses et particulièrement chez les enfants. Le groupe ajoute qu’aucun problème de sécurité n’a été signalé par le comité indépendant de surveillance des données (DMC) dans aucun groupe de vaccination ou d’âge.
"Il n’y a pas de surprise par rapport à ce qui a été communiqué auparavant", signalent les analystes d'Allinvest Securities.
Stifel remarque pour sa part que ces résultats confirment le potentiel du vaccin à offrir une protection annuelle contre la maladie de Lyme.
Deux études de phase III en cours
Valneva rappelle que deux études de phase III (dernière étape avant une potentielle commercialisation), sont en cours pour évaluer VLA15 contre cette maladie transmise par les tiques.
L'objectif étant que le géant américain Pfizer soumette une demande d’autorisation de mise sur le marché (BLA) à l’agence de santé américaine FDA et une demande d'autorisation de mise sur le marché (AMM) à l'Agence Européenne des Médicaments en 2026, sous réserve que les données de phase III obtenues soient positives.
Allinvest Securities estime que Valneva va communiquer des premiers résultats de phase III au premier semestre 2026, donnant lieu à un potentiel lancement commercial au second semestre de la même année.
Sur la base des données d'immunogénicité de la phase 2, les analystes de Stifel attribuent une probabilité de réussite relativement élevée de 80% au programme de phase III.
L'intermédiaire financier signale que sa thèse d'investissement est désormais centrée sur le VLA 15, qui représente environ 7 euros par action dans son modèle d'évaluation. Les analystes du bureau d'études considèrent les résultats de la phase III au premier semestre 2026 comme l'un des catalyseurs risque/récompense les plus attractifs dans le secteur biotechnologique européen au cours des six prochains mois.
"Si le vaccin est approuvé et commercialisé, Valneva pourrait recevoir de Pfizer jusqu’à 143 millions de dollars de paiements liés aux premières étapes de commercialisation du produit, des redevances sur les ventes allant de 14% à 22% ainsi que des paiements d’étape basés sur les ventes cumulées pouvant atteindre 100 millions de dollars", avait alors rappelé l'entreprise dans une précédente communication.
La semaine dernière, Valneva a aussi fait le point sur son portefeuille de vaccins en cours de développement. A l'occasion de la publication des résultats des neuf premiers mois, le groupe a rappelé que deux essais de phase II (étape qui évalue l'efficacité et la tolérance d'un traitement) étaient en cours pour un candidat-vaccin contre la shigellose, une diarrhée infectieuse aigüe, dont il n'existe aucun vaccin approuvé.
Il a aussi rappelé avoir publié récemment des résultats positifs d’innocuité et d’immunogénicité pour l’étude de phase I, phase qui évalue la sécurité d'emploi d'un traitement, de son candidat-vaccin VLA1601 contre le virus Zika. Pour autant, malgré un besoin médical avéré, Valneva a signalé que les voies réglementaires et les opportunités commerciales pour un vaccin potentiel contre le virus Zika restent incertaines.
Elle a aussi ajouté n'envisager de nouvelles étapes de développement pour VLA1601 que si des opportunités concrètes de financement privé et/ou public se concrétisaient.
Recevez toutes les infos sur VALNEVA en temps réel :
Par « push » sur votre mobile grâce à l’application BFM Bourse
Par email